检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
补体系统是天然免疫的重要组成部分,是人体免疫的第一道防线。补体系统由50多种可溶性蛋白和细胞表面受体组成,在清除病原体、调节免疫反应及维持体内稳态等过程中发挥关键作用。补体系统的功能紊乱与多种人类疾病有关,包括肾脏病、风湿性疾病、神经系统疾病和心血管疾病等。补体系统通过三条独立但相互关联的激活途径发挥功能:经典途径、凝集素途径和旁路途径。这三条途径最终在核心成分C3处汇合,C3经由C3转化酶裂解,生成C3a和C3b两个片段。C3a作为一种过敏毒素,诱导炎症反应;C3b则作为调理素结合在病原体表面,放大补体激活信号,增强被标记病原被吞噬细胞识别和清除的能力以及参与激活补体下游组分[1-4]。
C3转化酶是补体系统中的关键酶复合物,在激活补体级联反应中起核心作用。C3转化酶主要有两种形式:经典途径和凝集素途径中的C4b2a复合物,以及旁路途径中的C3bBb复合物。C4b2a中C4b由经典途径中的丝氨酸蛋白酶C1s或凝集素途径中的MASP-2切割C4形成,随后与C2结合形成酶原C4b2,C2再次被两种酶切割形成具有活性的C4b2a复合物;C3bBb转化酶则由C3b与因子B结合并在因子D作用下形成,形成的C3bBb复合物可被Properdin稳定。然而,C4b2a和C3bBb复合物高度不稳定,在形成后数分钟内即完全解离,这给其研究带来了很大挑战。补体核心环节的C3bBb转化酶识别C3的详细机制仍未明确。以及,经典/凝集素途径C4b2a转化酶的组装及其底物结合机制也尚不清楚,这在一定程度上限制了其作为治疗靶点的开发[5-8]。
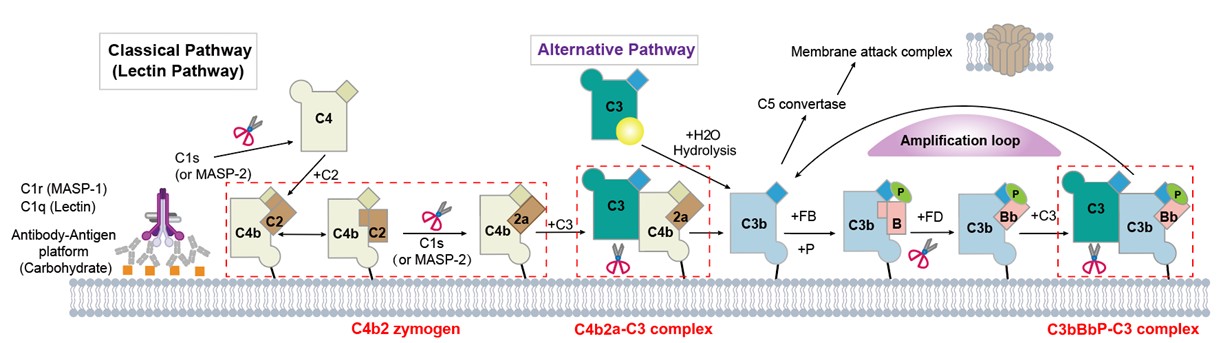
图1. 补体级联通路示意图。红色标记为本研究中解析完成的复合物
2026年2月20日,北京大学肖俊宇课题组联合北京大学第一医院肾内科赵明辉、谭颖团队在Science Advances期刊发表题为“Complement C3 recognition by C3 convertases”的研究论文,系统地揭示了补体系统两种C3转化酶的组装机制,同时获得了两种转化酶结合底物C3后形成的“Michaelis”复合物(酶与底物形成的中间体),阐明了补体系统转化酶识别并切割核心组分C3的分子机制,解决了补体生物学中长期存在的关键问题,为靶向补体的治疗研究提供了坚实的结构基础(图1)。
补体C3、C4等蛋白分子量大,结构复杂,重组表达困难,因此研究者首先从人血浆中纯化得到补体C3、C4等蛋白以进行后续实验。同时鉴于补体系统的两种转化酶高度不稳定的特性,研究者对转化酶组装条件进行优化,将生理条件下转化酶组装所需的镁离子替换为镍离子,从而显著延长转化酶的半衰期。C3转化酶是由催化单元(C2,CFB)与支架蛋白(C4b,C3b)共同组成,只有催化单元时无法实现对底物特异性的识别和切割,但完整的转化酶识别底物C3时具有高度特异性,研究者由此推测底物C3与转化酶结合时存在与催化单元之外的结合表位,这种额外的结合表位保证了底物识别的特异性。因此,研究者在转化酶复合物的催化单元C2和B因子中引入突变使其无法有效切割底物C3,从而保留了C3转化酶与底物C3处于结合状态下的复合物。
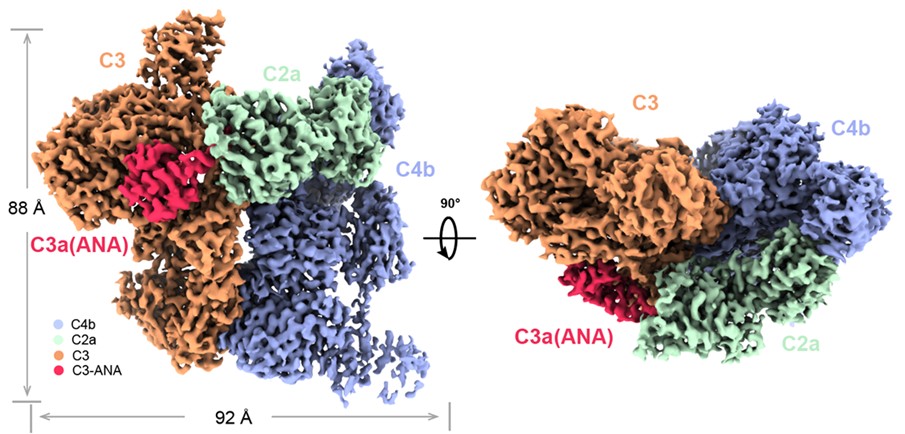
图2. 补体经典途径/凝集素途径C3转化酶与底物C3形成的复合物C4b2a-C3结构示意图
研究者根据以上思路制备样品并首先利用冷冻电子显微镜解析了经典途径和凝集素途径共同的转化酶C4b2a结合底物C3形成的“Michaelis”复合物C4b2a-C3的高分辨率结构(图2),可以观察到C3中的可剪切键位于ANA结构域的羧基端与α’-NT结构域的氨基端形成的loop状结构上,该loop插入到C2a的丝氨酸蛋白酶结构域的催化口袋中。除此之外,C4b与C3,C2与C3形成的相互作用界面提供了转化酶结合底物的亲和力,保证底物识别的特异性。值得注意的是,冷冻电镜样品中还存在两种经典途径转化酶的酶原形式C4b2(未展示),这在此前的研究中未被发现。C4b2复合物存在两种明显不同的构象,一种被命名为“loading”状态,即C2刚结合至C4b还未完成SP结构域的固定;另一种则成为“activation”状态,即活化状态,此时C2的SP结构域与C4b形成相互作用并被固定,固定后暴露出可被C1s切割的剪切键,切割后vWF结构域离去,从而完成C4b2到C4b2a的过程,形成最终具有活性的转化酶“C4b2a”,该过程的解析完整的阐明了C3转化酶从组装到成熟的分子过程。
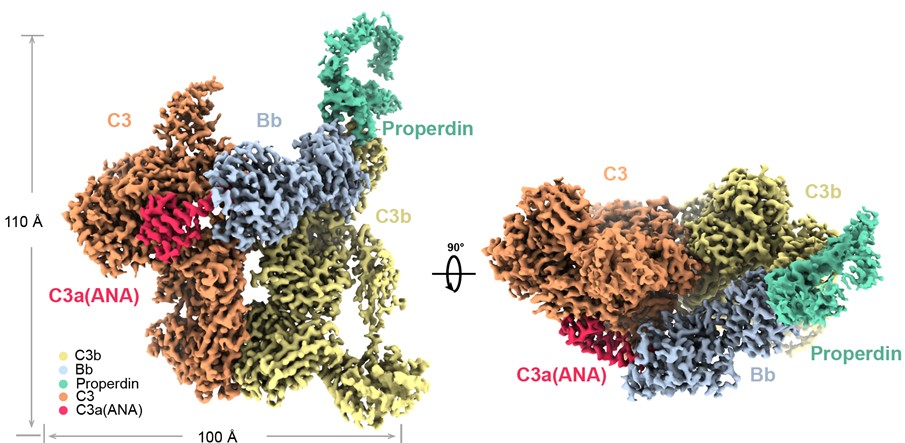
图3. 补体旁路途径C3转化酶与底物C3形成的复合物C3bBbP-C3结构示意图
研究者采用相似的思路解析了旁路途径转化酶C3bBb结合底物C3形成的“Michaelis”复合物C3bBbP-C3的高分辨结构(图3)。与C4b2a-C3类似,C3的可剪切键所在的loop结构插入到B因子的催化口袋中,且C3b与C3相互作用。C3b展示出与C4b类似的C3结合界面,但B因子与C3的相互作用界面展示出明显不同的特征,B因子与C3剪切键一侧的α’-NT结构域形成β片状结构,显然这些特征性的相互作用保证了底物识别的特异性。Properdin是补体系统中已知的唯一正向调节因子,结合在C3bBb上起到延长其半衰期的作用。研究者分析了Properdin与C3bBb的相互作用界面,发现Properdin主要通过TSR5-stirrup和TSR6-stirrup两个区域与C3b和Bb相互作用,起到加固C3bBb的功能。
最后,研究者利用获得的高分辨结构对两种代表性的靶向补体C3环节的药物作用机制进行分析,阐明了两种药物作用的分子机制,为开发补体靶向药物提供重要信息。
北京大学前沿交叉学科研究院2021级博士研究生贾长昊、yl6809永利官网博士后杨晓珂为论文的共同第一作者。肖俊宇教授与北京大学第一医院肾内科谭颖副教授、赵明辉教授为本文的共同通讯作者。
本研究得到了国家自然科学基金和国家重点研发计划的资助。北京大学第一医院肾内科、北京大学冷冻电镜平台、昌平实验室冷冻电镜平台、yl6809永利官网仪器中心为本研究提供了有力保障。
原文链接:https://www.science.org/doi/10.1126/sciadv.adz5404
参考文献:
1.Dalakas, M. C., Alexopoulos, H. & Spaeth, P. J. Complement in neurological disorders and emerging complement-targeted therapeutics. Nat Rev Neurol 16, 601-617 (2020). https://doi.org:10.1038/s41582-020-0400-0.
2. Holers, V. M. Complement therapeutics are coming of age in rheumatology. Nat Rev Rheumatol 19, 470-485 (2023). https://doi.org:10.1038/s41584-023-00981-x.
3. Petr, V. & Thurman, J. M. The role of complement in kidney disease. Nat Rev Nephrol 19, 771-787 (2023). https://doi.org:10.1038/s41581-023-00766-1.
4.Maffia, P., Mauro, C., Case, A. & Kemper, C. Canonical and non-canonical roles of complement in atherosclerosis. Nat Rev Cardiol 21, 743-761 (2024). https://doi.org:10.1038/s41569-024-01016-y.
5.Merle, N. S., Church, S. E., Fremeaux-Bacchi, V. & Roumenina, L. T. Complement System Part I - Molecular Mechanisms of Activation and Regulation. Front Immunol. 6, 262 (2015). https://doi.org:10.3389/fimmu.2015.00262.
6.Mastellos, D. C., Hajishengallis, G. & Lambris, J. D. A guide to complement biology, pathology and therapeutic opportunity. Nat Rev Immunol 24, 118-141 (2024). https://doi.org:10.1038/s41577-023-00926-1.
7.Ricklin, D., Hajishengallis, G., Yang, K. & Lambris, J. D. Complement: a key system for immune surveillance and homeostasis. Nat Immunol 11, 785-797 (2010). https://doi.org:10.1038/ni.1923.
8.Ricklin, D., Reis, E. S., Mastellos, D. C., Gros, P. & Lambris, J. D. Complement component C3 - The "Swiss Army Knife" of innate immunity and host defense. Immunol Rev 274, 33-58 (2016). https://doi.org:10.1111/imr.12500.