检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
在RNA修饰研究中,N6-甲基腺苷(m6A)被认为是真核生物mRNA上分布最广泛且功能多样的修饰形式之一【1】。大量研究表明,m6A可通过调控RNA的剪接、稳定性、翻译及降解过程,深度参与基因表达调控【2】。与此同时,m6A修饰也存在于多类非编码RNA中,比如染色质相关调控RNA(chromatin-associated regulatory RNAs,carRNAs),并参与染色质功能调控,进一步增加了全面理解m6A作用模式的复杂性【3】。现有研究策略主要依赖对m6A调节因子的全局性干预,这种方法难以区分不同RNA分子、不同修饰位点在不同细胞环境下的功能差异,从而限制了对m6A精细调控逻辑的深入解析。
2025年12月31日,yl6809永利官网、北大-清华生命科学联合中心、北京大学核糖核酸北京研究中心刘君课题组在Cell发表了题为“FOCAS: Transcriptome-wide screening of individual m6A sites functionally dissects epitranscriptomic control of gene expression in cancer”的研究论文。该研究建立了FOCAS(Functional m6A Sites Detection by CRISPR-dCas13b-FTO Screening)方法,实现了m6A功能研究在位点分辨率上的关键突破。FOCAS基于改造的CRISPR-dCas13b系统,将去甲基化酶FTO精准定位至RNA特定区域,从而在不改变DNA/RNA序列和不显著影响全局m6A水平的前提下,实现对特定m6A修饰位点的靶向去甲基化。这一策略不仅适用于mRNA,还可以同时覆盖非编码RNA,为在全转录组尺度上系统解析m6A的功能提供了技术基础。

图1. 论文截图
基于FOCAS策略,研究者在四种人类癌细胞系中系统评估了m6A修饰对细胞增殖能力的影响,共鉴定出4,475个由m6A调控、显著影响细胞生长的功能基因。这些基因中的大多数此前未明确建立与m6A或肿瘤直接相关,提示m6A调控网络在癌细胞中的作用范围远超当前认知。进一步的位点层面分析揭示了m6A调控的高度异质性和基因背景依赖性。研究发现,即使在同一基因内部,不同m6A修饰位点也可能通过截然不同的机制影响RNA命运,从而对细胞表型产生相反的效应。这种差异主要源于不同m6A阅读蛋白的选择性结合。FOCAS使这种依赖于位点、阅读蛋白及细胞环境的m6A精细调控模式得以被系统揭示。
接下来,研究者使用FOCAS进一步探究了carRNA上m6A修饰的功能。结果显示,在三类carRNA——增强子RNA(enhancer RNAs, eRNAs)、启动子相关RNA(promoter-associated RNAs, paRNAs)及转座子来源RNA(retrotransposon RNAs, reRNA)上均鉴定出影响肿瘤增殖的关键m6A位点,表明carRNA上的m6A修饰同样具有重要的调控功能。进一步分析显示,在相同基因背景下,mRNA区域及其邻近的carRNA区域往往难以同时筛选到有效的sgRNA,而大部分携带关键m6A位点的carRNA,其邻近的编码基因与肿瘤特征具有更低的相关性。这些结果表明,携带m6A修饰的carRNA更倾向于通过反式调控作用发挥功能。
随后,研究者系统比较了FOCAS在四种细胞系中鉴定的共性和差异性关键m6A峰(FOCAS-identified Peaks, FiPeaks),并据此将m⁶A调控模式划分为四种细胞系中都作用的“广泛型”(Universal-FiPeaks)与仅在特定细胞中作用的“特异型”(Unique-FiPeaks)两类。尽管多数m6A峰在四种肿瘤细胞系中均存在,但其往往仅在单一细胞系中调控肿瘤细胞生长,提示关键m6A位点的作用并非仅由修饰是否存在决定,而更取决于具体位点本身的生物学功能。对FiPeaks所在的RNA种类进一步分析显示,Universal-FiPeaks主要富集于mRNA,其所在基因在多种肿瘤中具有一致功能并与患者预后密切相关;而Unique-FiPeaks则更倾向富集于carRNA,表明非编码RNA上的m6A修饰在肿瘤类型特异性调控中发挥重要作用。这种功能分层为RNA修饰相关靶点的精准筛选和肿瘤特异性干预策略提供了重要理论依据。
值得注意的是,FOCAS进一步揭示了m6A修饰与转录调控网络之间的耦合关系。在肝癌细胞模型中,研究者鉴定出一组受m6A调控的关键转录调节因子,靶向这些基因上的修饰呈现“模块化”的调控特征,且同一模块内的转录表达谱表现出高度一致的变化模式。其中,KCTD1被鉴定为一个此前未被报道的、受m6A调控的潜在泛癌抑癌因子,并参与调控H3K4me3组蛋白修饰水平,显示出FOCAS在发现关键功能基因及作用机制方面的独特优势。
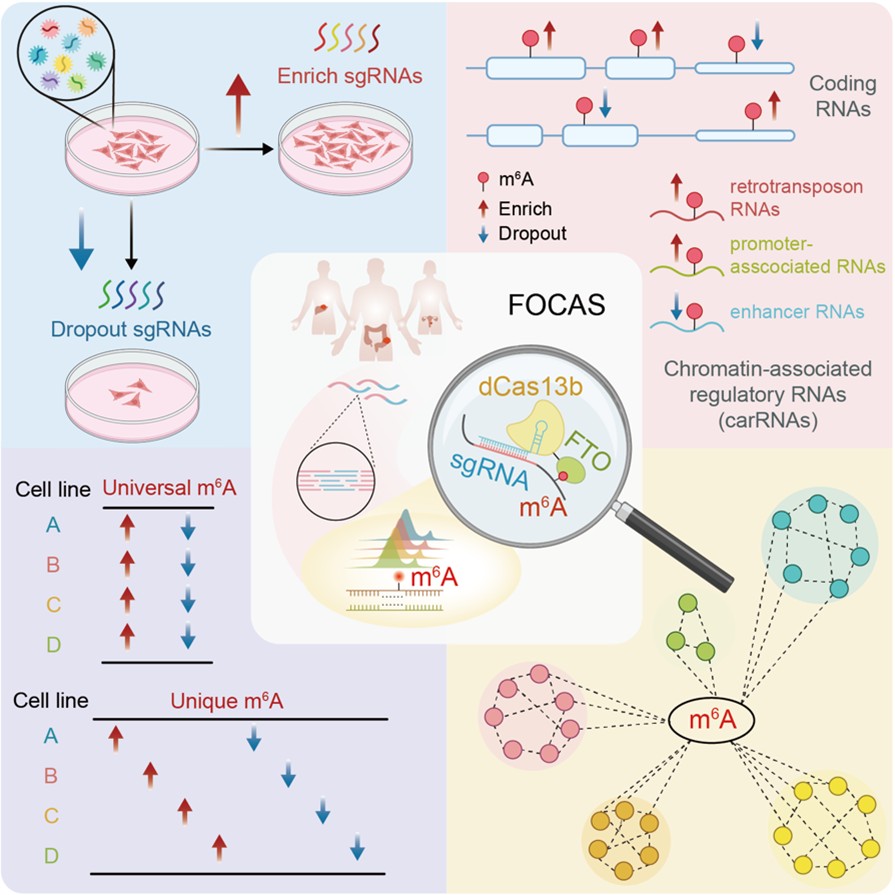
图2. FOCAS方法鉴定肿瘤中全转录组关键m6A位点并解析其调控模式
综上所述,该研究通过FOCAS平台实现了对m6A修饰位点分辨率的精细调控功能的解析。研究结果表明,特定m6A位点本身即可作为精细的调控单元,深度参与基因表达调控及细胞命运决定。FOCAS不仅为理解m6A修饰的复杂调控逻辑提供了通用方法学框架,也为RNA修饰介导的肿瘤精准治疗研究奠定了重要基础。
yl6809永利官网、北大-清华生命科学联合中心、北京大学核糖核酸北京研究中心刘君研究员为本文的通讯作者。北京大学前沿交叉学科研究院2022级博士研究生张薪泞、我院2022级博士研究生张艺凡与2021级博士研究生刘欣宇为本文共同第一作者。yl6809永利官网魏文胜教授、胡婧研究员及同济大学高亚威教授为本工作提供了重要支持和贡献。本研究得到了国家重点研发计划、国家自然科学基金委、北京市自然科学基金委、北大-清华生命科学联合中心、yl6809永利官网及核糖核酸北京研究中心、基金功能研究与操控全国重点实验室和深圳湾实验室重点项目等项目和机构的支持。
原文链接:https://doi.org/10.1016/j.cell.2025.11.037
参考文献:
1. Roundtree, I.A., Evans, M.E., Pan, T., and He, C. (2017). Dynamic RNA modifications in gene expression regulation. Cell 169, 1187-1200. 10.1016/j.cell.2017.05.045.
2. Deng, X., Qing, Y., Horne, D., Huang, H., and Chen, J. (2023). The roles and implications of RNA m6A modification in cancer. Nat. Rev. Clin. Oncol. 20, 507-526. 10.1038/s41571-023-00774-x.
3. Liu, J., Dou, X., Chen, C., Chen, C., Liu, C., Xu, M.M., Zhao, S., Shen, B., Gao, Y., Han, D., and He, C. (2020). N6-methyladenosine of chromosome-associated regulatory RNA regulates chromatin state and transcription. Science 367, 580-586. 10.1126/science.aay6018.