检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
细胞内氧化应激是一柄双刃剑,适度氧化是能量代谢、信号传导的必需环节,但过度氧化则会导致蛋白损伤甚至降解,威胁细胞生存[1]。还原型谷胱甘肽(GSH)作为细胞核心抗氧化分子[2],其高达毫摩尔级含量如何得到精准的调控是长期以来领域内的未解之谜:如何在保障必要氧化反应的同时,避免蛋白氧化[3]?这一关键科学问题近日迎来突破性解答。
2025年12月19日,yl6809永利官网、基因功能研究与操控全国重点实验室、生命科学联合中心王伟团队,在Molecular Plant期刊上在线发表题为“Duet between stress granules and glutathionylation regulates cytosolic redox state to maintain proteostasis in Arabidopsis”的研究论文。该研究首次阐明蛋白谷胱甘肽化修饰与应激颗粒(Stress Granule,SG)的双向协同调控机制,不仅破解了细胞氧化平衡难题,更重新定义了SG的作为无膜细胞器整体的生物学新功能。
王伟课题组前期研究发现,在水杨酸(Salicylic Acid,SA)诱导的氧化应激条件下,细胞会大量形成由RNA与蛋白组成的SG,这类无膜细胞器可招募mRNA及翻译相关元件,从而调控应激状态下的细胞翻译水平[4]。在此基础上,作者进一步观察到,SG同时富集了大量与GSH合成及代谢相关的酶及蛋白,提示其可能参与细胞氧化还原调控。
为进一步深入研究SG的功能和GSH调控的细胞内氧化还原关系,作者开发了基于激活型荧光探针的点击化学反应实现了蛋白质谷胱甘肽化修饰的活体成像技术(Click-activated metabolic Labeling and imaging of glutathionylation,CamLog)。该技术无需转入外源基因,可实现天然生理条件下谷胱甘肽化修饰蛋白的动态可视化。借助CamLog技术,作者成功在拟南芥根部观察到SA诱导形成的谷胱甘肽化蛋白凝聚体(图1)。
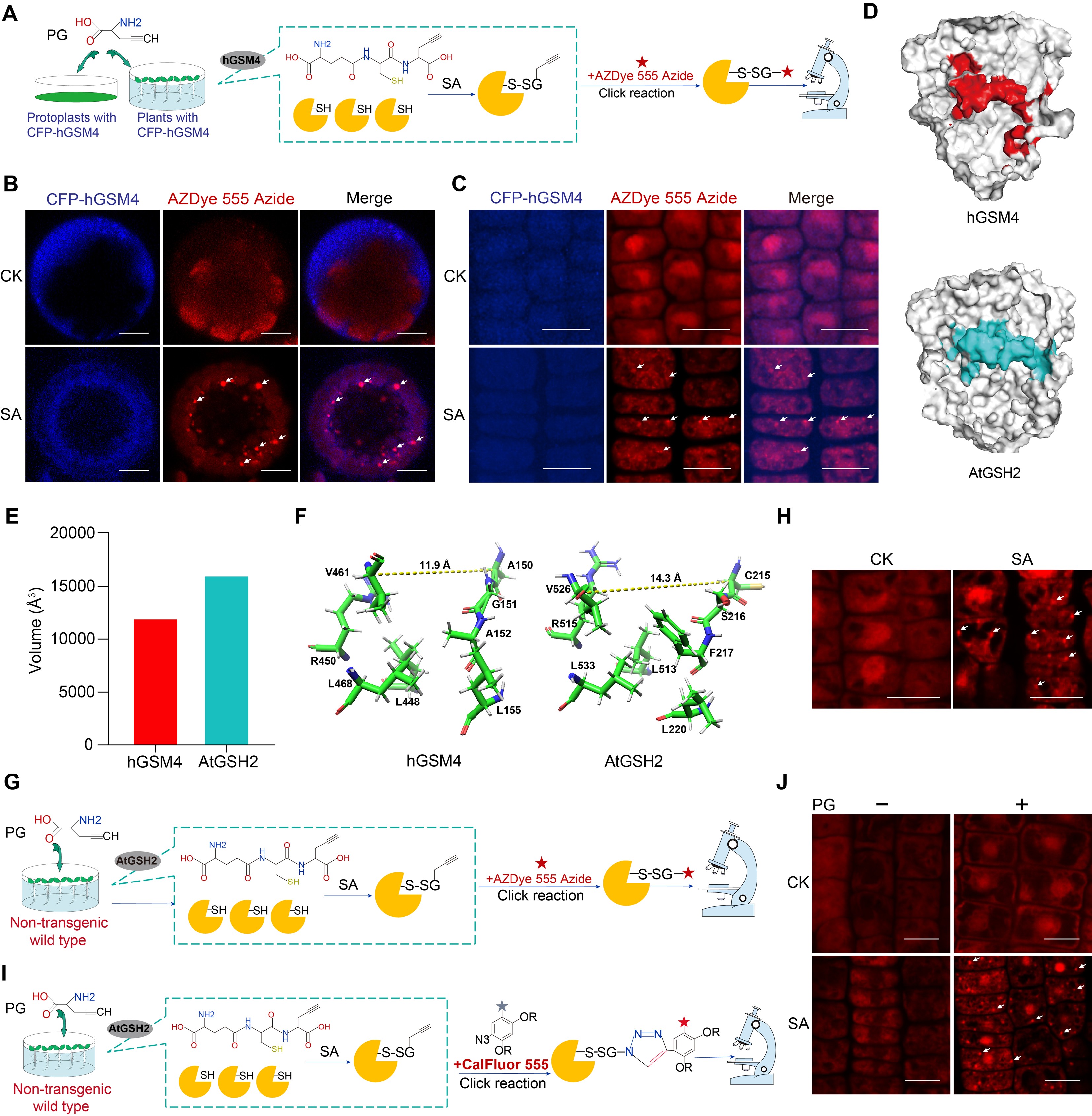
图1. CamLog技术观察SA诱导形成的谷胱甘肽化蛋白凝聚体
接着作者通过SG标志蛋白共定位、SG富集蛋白的谷胱甘肽化修饰与质谱鉴定,证实了这些凝聚体是SG的核心组成部分。机制研究显示,SG的形成依赖蛋白液-液相分离(LLPS),而过度氧化会削弱蛋白的LLPS能力。SA诱导的蛋白谷胱甘肽化修饰,可赋予蛋白氧化还原缓冲能力,确保其在氧化环境中维持LLPS活性,进而促进SG组装。实验证实,利用TCEP抑制全局蛋白谷胱甘肽化修饰,可显著抑制SG的形成,明确了该修饰是驱动SG组装的关键分子基础。
随后作者揭示了SG的双重调控机制。作为无膜细胞器,一方面SG能在氧化态细胞质中构建还原性微环境,对翻译有关蛋白进行隔离保护,从而抑制氧化诱导的蛋白降解,突变SG标志蛋白RBP47B谷胱甘肽化修饰的半胱氨酸位点,不仅降低了其流动性,还抑制了植株对SA响应。另一方面,SG招募GSH生物合成的限速酶GSH1,通过抑制细胞质中的GSH合成,维持应激状态下的适度氧化水平,保障氧化信号通路的正常激活(图2)。
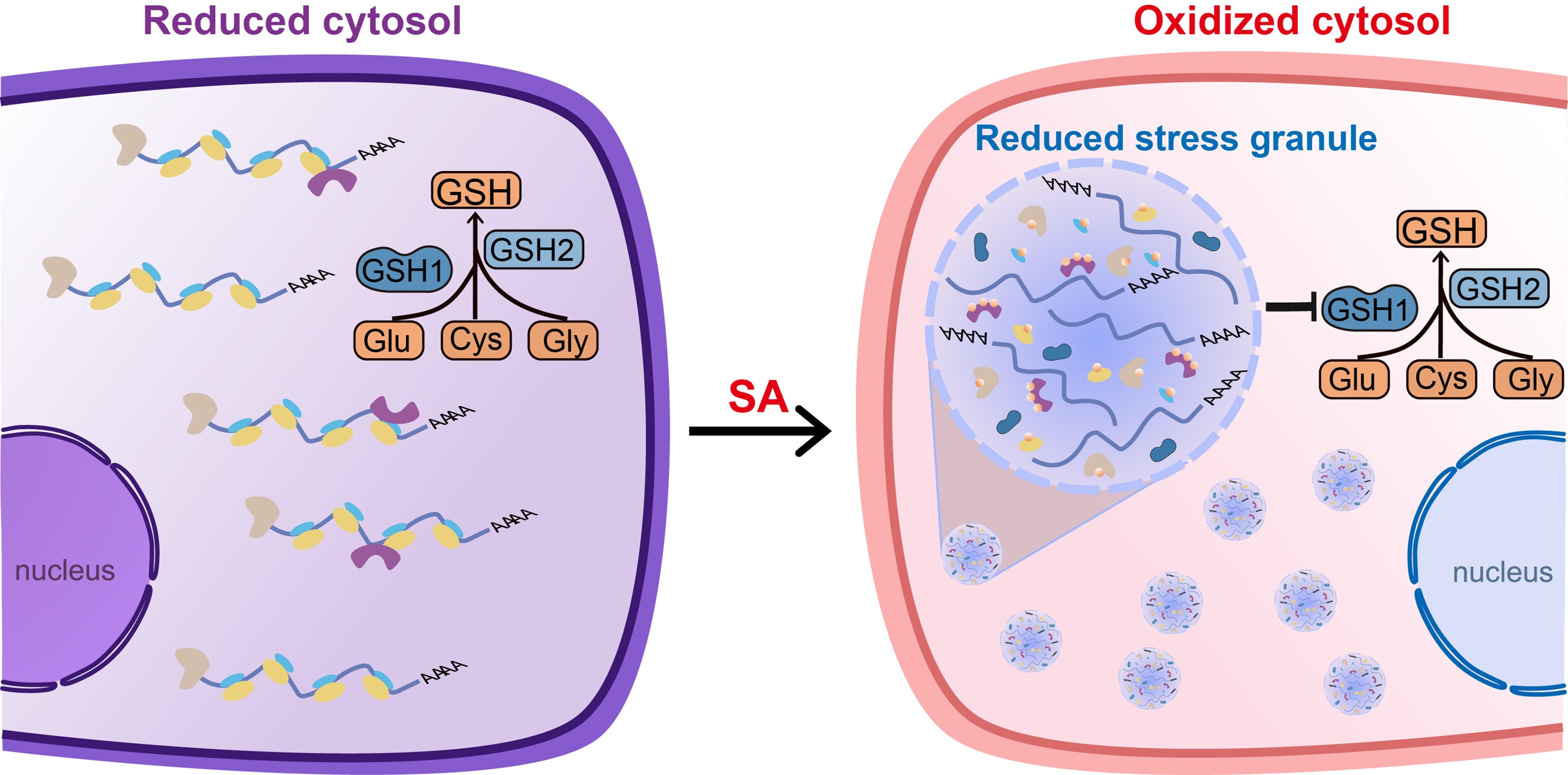
图2. SG与谷胱甘肽化修饰协同作用,塑造出氧化还原电势的空间异质性分布
这一发现重新定义了SG作为无膜细胞器的整体性生物学功能,表明SG并不仅仅只是应激条件下的翻译调控场所,也是主动调控细胞抗氧化能力的核心枢纽。同时,SG与谷胱甘肽化修饰协同作用塑造的细胞质中氧化还原电势异质性,打破了人们对细胞抗氧化机制的传统认知,为重新理解细胞抗氧化机制提供了全新理论,也对易受氧化损伤的组织研究具有重要启示。
近年来,王伟课题组在植物SG研究领域持续产出,先后在Nature Plants,2023 [4];Molecular Cell,2024 [5];Molecular Plant,2025发表系列论文,系统解析了SG的功能机制,其涉及的技术和方法为该研究领域提供了指导。
yl6809永利官网、基因功能研究与操控全国重点实验室、生命科学联合中心王伟研究员为论文通讯作者。北京大学博士后赵帅(已出站,现就职于首都师范大学)、博士后谢周丽(已出站,现就职于华中农业大学)和在读博士生陈効远为该论文的共同第一作者;首都师范大学周冕研究组参与了本研究。本研究得到了国家自然科学基金、基因功能研究与操控全国重点实验室、生命科学联合中心、首都师范大学、北京市自然科学基金、北京市科技新星计划和海外交流引进博士后等项目的资助。
原文链接:https://doi.org/10.1016/j.molp.2025.12.018
参考文献:
1. Waszczak, C., M. Carmody, and J. Kangasjärvi, Reactive Oxygen Species in Plant Signaling. Annu Rev Plant Biol, 2018. 69: p. 209-236.
2. Noctor, G., et al., Glutathione in plants: an integrated overview. Plant Cell Environ, 2012. 35(2): p. 454-84.
3. Noctor, G., J.-P. Reichheld, and C.H. Foyer, ROS-related redox regulation and signaling in plants. Seminars in Cell & Developmental Biology, 2017. 80: p. 3-12.
4. Xie, Z., et al., Phenolic acid-induced phase separation and translation inhibition mediate plant interspecific competition. Nature Plants, 2023. 9: p. 1481-1499.
5. Xie, Z., et al., Proteasome resides in and dismantles plant heat stress granules constitutively. Mol Cell, 2024. 84(17): p. 3320-3335 e7.