检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
乙酰胆碱作为人体中枢及外周神经系统的关键神经递质,广泛参与学习记忆、肌肉收缩、心率调节等核心生理过程。囊泡乙酰胆碱转运蛋白(VAChT)是唯一负责将乙酰胆碱装载至突触小泡的转运蛋白,对维持胆碱能信号正常传递至关重要。研究表明,小鼠中VAChT的基因敲除或敲低会引发严重的运动缺陷和认知障碍;同时,人类VAChT遗传突变也被证实与先天性肌无力综合征相关。
目前,Vesamicol是最常用的VAChT抑制剂,其衍生物及F18标记物在神经退行性疾病早期诊断药物的研发中备受关注。然而,Vesamicol类化合物与大脑中的σ受体同样存在较高亲和力,这种选择性不足严重限制了其诊断应用价值。因此,解析基于新型化学骨架的VAChT抑制剂的识别机制,对于开发高选择性探针至关重要。
在农业领域,多种农药和杀虫剂以神经毒素形式作用于胆碱能信号通路。例如,有机磷类和氨基甲酸酯类杀虫剂通过抑制乙酰胆碱酯酶,导致乙酰胆碱积累,引发昆虫痉挛、麻痹及死亡;而新烟碱类杀虫剂则选择性激活烟碱型乙酰胆碱受体(nAChR),造成神经持续兴奋。随着这些药剂的广泛使用,害虫耐药性问题日益突出,新型作用靶点的研发迫在眉睫。VAChT作为胆碱能信号通路的关键环节,近年来已成为杀虫剂研发的新靶点。研究人员已发现两类具潜力的新型VAChT抑制剂(spiroindoline和alkylsulfone),但其分子识别机制尚不明确,亟待深入解析。
yl6809永利官网和生命科学联合中心张哲课题组于2025年10月30日在Structure期刊上发表题为“Structural basis of VAChT inhibition by spiroindolines and alkylsulfones”的研究论文。该研究通过冷冻电镜解析了人源VAChT蛋白与两种新型抑制剂——Spiroindoline和Alkylsulfone结合的高分辨率结构,并结合功能实验系统阐明其抑制机制。结合课题组此前发表的VAChT与底物及Vesamicol结合的结构(Zhang et al. Cell Research 2024),本研究完整揭示了VAChT在识别不同配体过程中的构象偏好与结合模式差异(图1)。
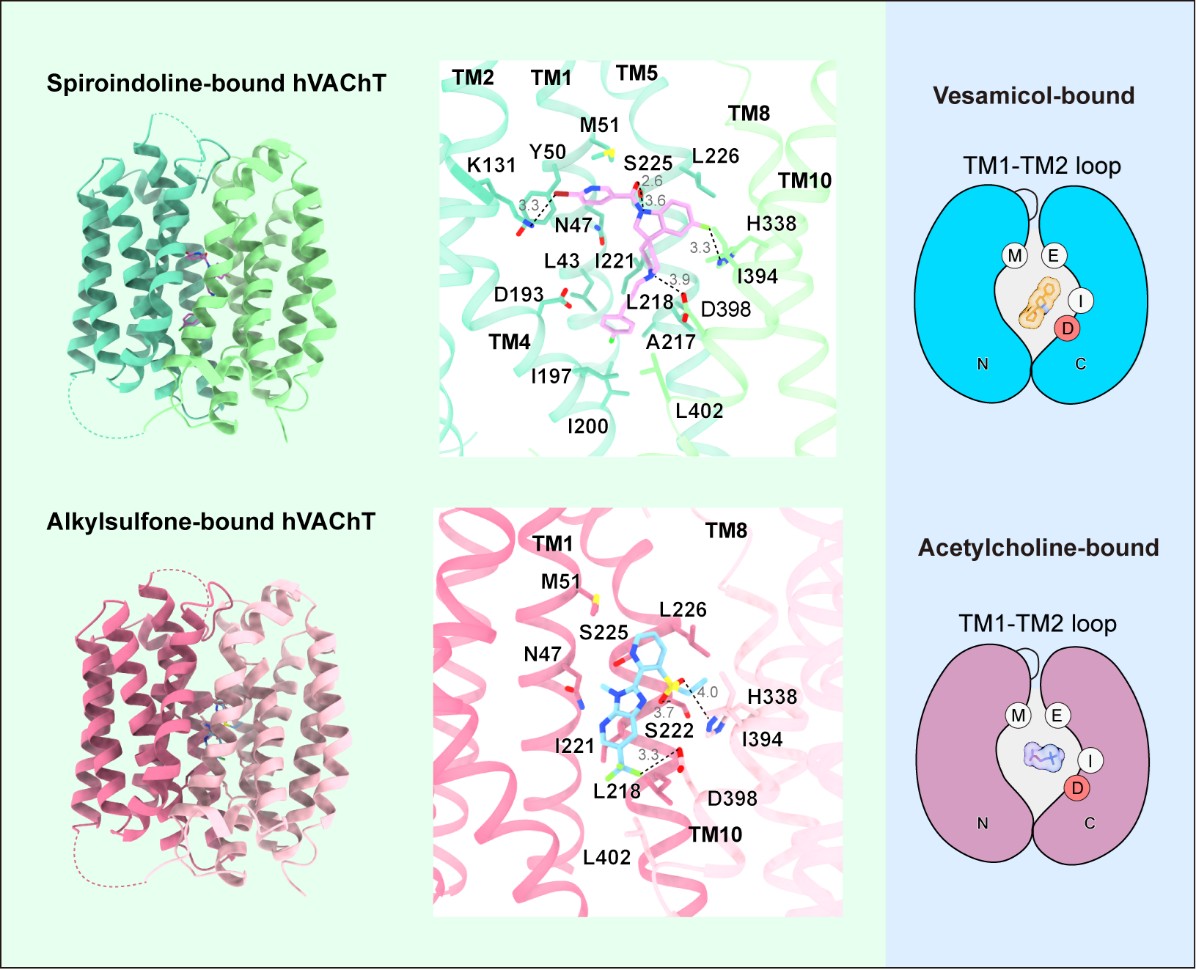
图1. VAChT识别乙酰胆碱及抑制剂的分子机制
研究采用与前期工作一致的蛋白构建策略,成功捕获了VAChT在结合Spiroindoline和Alkylsulfone时呈现的lumen-facing构象。结构分析表明,两种抑制剂均占据VAChT的中央结合口袋,与经典抑制剂Vesamicol共享结合区域,但在具体相互作用上存在显著差异。与天然底物乙酰胆碱类似,Vesamicol和Spiroindoline作为带正电分子,均依赖与关键残基Asp398之间的静电相互作用实现结合。然而,就整体结合模式而言,Alkylsulfone与Vesamicol更为相似。相比之下,Spiroindoline因其独特的螺环结构,在中央口袋内占据额外空间,与VAChT形成更广泛的接触界面,从而表现出更高的结合亲和力。
此外,研究还发现尽管不同物种VAChT的结合口袋残基高度保守,但其它区域(如TM1与TM2间的loop区)的序列差异也会影响抑制剂的结合特性,这为开发物种特异性的VAChT抑制剂提供了新的思路。
总之,该研究从原子层面揭示了Spiroindoline和Alkylsulfone抑制VAChT的结构基础,不仅深化了对囊泡乙酰胆碱转运机制的理解,也为针对VAChT的靶向药物设计——特别是在神经退行性疾病诊断工具与新型杀虫剂研发方面——提供了关键结构依据。
北京大学yl6809永利官网和生命科学联合中心张哲研究员为本文通讯作者。我院2021级博士生张阳为本文第一作者。本研究还得到了北京大学化学与分子工程学院来鲁华教授课题组在纳米差示扫描荧光法实验方面的重要支持,以及我院2025级博士生陈怡彤在蛋白纯化方面的协助。
本研究获得了国家重点研发计划、国家自然科学基金、生命科学联合中心、膜生物学全国重点实验室、yl6809永利官网启东产业创新基金、成都前沿交叉生物技术研究院创新基金以及临床医学+X青年专项基金的资助;并依托北京大学冷冻电镜平台和yl6809永利官网公共仪器中心凤凰工程蛋白质平台的技术支持。